什么是Ksp
的有关信息介绍如下:沉淀平衡常数,简称溶度积。
该反应的平衡常数表达式如下:
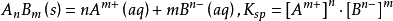
AgCl的溶度积:Ksp(AgCl)=[Ag+][Cl-]
在一定温度下,不溶性电解质晶体与溶于溶液中的离子之间存在着沉淀、溶解和形成的平衡,称为沉淀溶解平衡。当不溶性电解质Agci加入水中时,固体表面的部分Ag和Cl在水分子的恒定作用下脱离Agcl固体,与水分子结合,合成水化离子进入溶液,称为沉淀的溶解。
同时,溶液中的水合Ag+和Cl-不断移动,其中一些被AgCl固体表面带相反电荷的离子吸引,再重新组合形成AgCl固体。固体AgCI,这一过程称为沉淀形成。不溶性电解质的溶解和形成是可逆的过程。
经过一段时间后,当不溶性电解质的溶解速率和形成速率相等时,溶液中离子的浓度不再改变,溶液中不溶性电解质固体与水化离子之间的沉淀和溶解平衡建立起来。
扩展资料:
Ksp规则:
将Q的大小与Ksp进行比较,根据化学平衡移动原理,可知:
当Q>Ksp时,溶液为过饱和溶液,平衡往左移动,沉淀析出;
当Q<Ksp时,溶液为不饱和溶液,若溶液中仍有沉淀存在,平衡往右移动,沉淀溶解;
当Q=Ksp时,溶液为饱和溶液,处于沉淀溶解平衡状态,既无沉淀生成,也无沉淀溶解。
上述规则,可以用来判断沉淀生成和溶解的发生,称为溶度积规则 。
参考资料来源:百度百科-Ksp
参考资料来源:百度百科-溶度积



