什么是溶液。
的有关信息介绍如下:
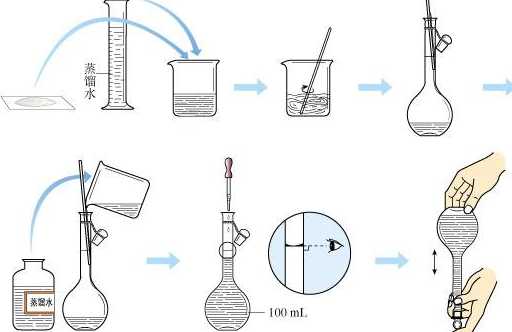
一、溶液的定义:编辑本段 分散质的粒子直径<1nm(10-9m)的分散系。分散质是分子或离子,具有透明、均匀、稳定的宏观特征。 溶液是一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物。其中,溶质相当于分散质,溶剂相当于分散剂。在生活中常见的溶液有蔗糖溶液、碘酒、澄清石灰水、稀盐酸、盐水、空气等。 按聚集态不同分类: 气态溶液:气体混合物,简称气体(如空气)。 液态溶液:气体或固体在液态中的溶解或液液相溶,简称溶液(如盐水)。 固态溶液:彼此呈分子分散的固体混合物,简称固溶体(如合金)。 读法:一般读作“某某(溶质)的某(溶剂)溶液”,如酒精可读作“乙醇的水溶液” 说明:如果溶剂是水,可以简称为某溶液 如“乙醇的水溶液”可以叫做乙醇溶液 如果两种液体互溶,有水则以水为溶剂,否则以质量大的为溶剂 二、溶液的组成:编辑本段 1.溶质: 被溶解的物质 2.溶剂: 起溶解作用的物质 3.两种液互溶时溶,一般把量多的一种叫溶剂,量少的一种叫溶质。 4.两种液互溶时溶,若其中一种是水,一般将水称为溶剂。 其中,水(H2O)是最常用的溶剂,能溶解很多种物质。汽油、酒精、氯仿、香蕉水也是常用的溶剂,如汽油能溶解油脂,酒精能溶解碘等等。 溶质可以是固体,也可以是液体或气体;如果两种液体互相溶解,一般把量多的一种叫做溶剂,量少的一种叫做溶质。 三、溶液的性质:编辑本段 1.均一性:溶液各处的组成和性质完全一样; 2.稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离。 3.透明性:是由于溶质的单个分子或离子的体积很小(直径小于1nm,因而不能阻挡光线的透过。溶液透明不是指溶液无色,例如硫酸亚铁溶液呈浅绿色。 4(液体).能透过滤纸:溶液中溶质粒子直径小于1nm,能透过滤纸。 四、溶液的分类:编辑本段 饱和溶液:在一定温度、一定量的溶剂中,溶质不能继续溶解的溶液。 不饱和溶液:在一定温度、一定量的溶剂中,溶质可以继续溶解的溶液。 过饱和溶液:在一定温度、一定量的溶剂中,溶质不能继续溶解的且已有部分溶质沉降。可以通过加溶剂或过滤的方法,使得过饱和溶液变为饱和溶液。 饱和与不饱和溶液的互相转化: 不饱和溶液通过增加溶质(对一切溶液适用)或降低温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则须升高温度,如石灰水)、蒸发溶剂(溶剂是液体时)能转化为饱和溶液。 饱和溶液通过增加溶剂(对一切溶液适用)或升高温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则降低温度,如石灰水)能转化为不饱和溶液。 规则溶液:1929年J.H.Hildebrand提出了规则溶液(Regular Solution)模型,并对规则溶液定义为:形成(混合)热不为零,而混合熵为理想溶液的混合熵,即 △H^M≠0 △S^M=△S理想混合=-R∑xi lnxi 规则溶液是更接近实际溶液的一种溶液。它的形成除混合熵不等于零外,其他特性和理想溶液一致。由规则溶液推导出的热力学规律,广泛应用于非电解质溶液,尤其对许多合金溶液的应用,更为合适。因此,对于冶金和金属材料科学来说,规则溶液理论是十分重要的。 五、关于溶液的相关概念、计算及配制编辑本段 相关概念 溶解度:一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。如果不指明溶剂,一般说的溶解度指的是物质在水中的溶解度。 气体溶解度是指压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的体积。 计算 溶液质量=溶质质量 + 溶剂质量 但是溶液体积<溶质体积 + 溶剂体积 溶质的质量分数=溶质质量/溶液质量 × 100% 溶质质量=溶液质量 × 溶质的质量分数 配制 实验室里,溶液的一般配制步骤: 1.按溶质的质量分数:计算、称量、量取、溶解、装瓶贴签。 2.按物质的量浓度:计算、称量、溶解、(冷却)、移液、洗涤、定容、摇匀。 六、溶液的用途编辑本段 在溶液里进行的化学反应通常是比较快的。所以,在实验室里或化工生产中,要使两种能起反应的固体起反应,常常先把它们溶解,然后把两种溶液混合,并加以振荡或搅动,以加快反应的进行。 溶液对动植物的生理活动也有很大意义。动物摄取食物里的养分,必须经过消化,变成溶液,才能吸收。在动物体内氧气和二氧化碳也是溶解在血液中进行循环的。在医疗上用的葡萄糖溶液和生理盐水、医治细菌感染引起的各种炎症的注射液(如庆大霉素、卡那霉素)、各种眼药水等,都是按一定的要求配成溶液使用的。植物从土壤里获得各种养料,也要成为溶液,才能由根部吸收。土壤里含有水分,里面溶解了多种物质,形成土壤溶液,土壤溶液里就含有植物需要的养料。许多肥料,像人粪尿、牛马粪、农作物秸秆、 野草等等,在施用以前都要经过腐熟的过程,目的之一是使复杂的难溶的有机物变成简单的易溶的物质,这些物质能溶解在土壤溶液里,供农作物吸收。 七、溶液的形成编辑本段 溶液形成的过程伴随着能量、体积变化,有时还有颜色变化。溶解是一个特殊的物理化学变化,分为两个过程。一是溶质分子或离子的离散,这个过程需要吸热以克服分子间的吸引力,同时增大体积;二是溶剂分子和溶质分子的结合,这是一个放热过程同时体积缩小。整个过程的综合情况是两方面的共同作用。 八、溶液的稀释 根据稀释前后溶质的总量不变进行运算,无论是用水,或是用稀溶液来稀释浓溶液,都可计算。 (1)用水稀释浓溶液 设稀释前的浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%。 则可得m×a%=(m+n)×b% (2)用稀溶液稀释浓溶液 设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两液混合后的溶质的质量分数为c%。 则可得 A×a%+B×b%=(A+B)×c% (1) 或 A/B=(c%-b%)/(a%-c%) (2)